|
ビヨントラ®の有効性と安全性
ー国内第III相試験(302試験)ー
1. 試験概要
| 目的 | 日本人のATTR-CM患者を対象にビヨントラ®の有効性、安全性、忍容性、薬物動態(PK)及び薬力学(PD)を評価する。 |
|---|---|
| 対象 |
症候性の野生型又は変異型ATTR-CMを有する日本人患者 25例 |
| 方法 | スクリーニング期に適格性が確認された患者に、ビヨントラ錠800mgを1日2回、12ヵ月間経口投与した(Part A)。Part Aの最終来院(12ヵ月)後、患者はPart B(Part
A後18ヵ月間)に移行し、ビヨントラ錠800mg 1日2回の経口投与を継続した。治療期での30ヵ月間の投与及び最終評価を完了した後、患者は継続投与期に移行し、ビヨントラ錠800mg
1日2回の経口投与を継続できることとした。

|
| 主要評価項目 |
|
| 副次評価項目 |
|
| 探索的評価項目 |
|
| 解析計画 |
|
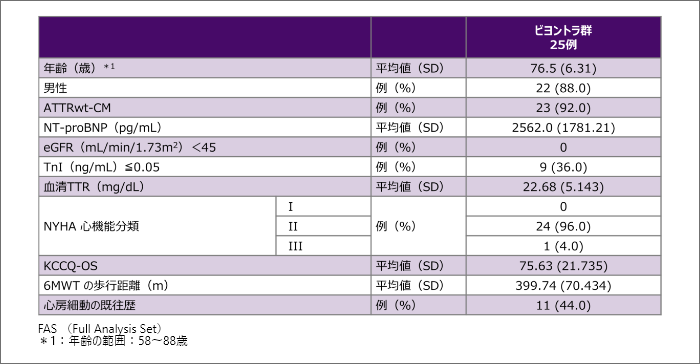
患者背景
2. 有効性
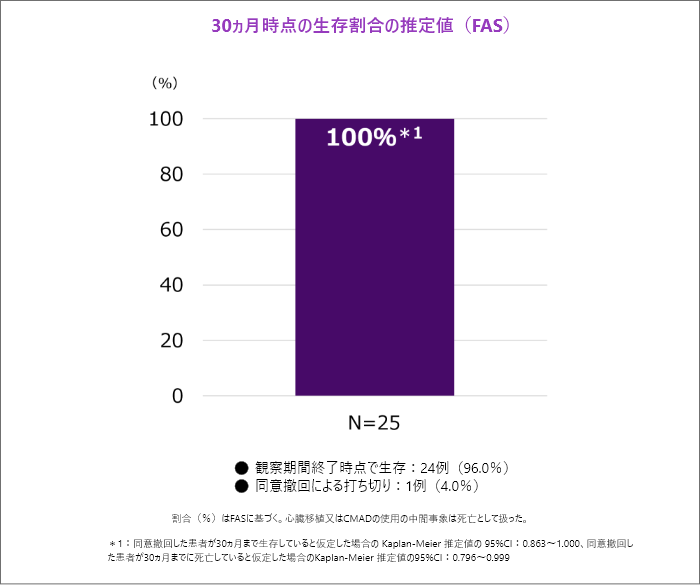
30ヵ月時点の全死因死亡[主要評価項目]
- 本試験では死亡が認められませんでした。
30ヵ月時点の心血管症状に関連する入院[主要評価項目]
- 心血管症状に関連する入院イベントは25例中5例(8件)に認められ、その頻度は0.1329回/年でした。

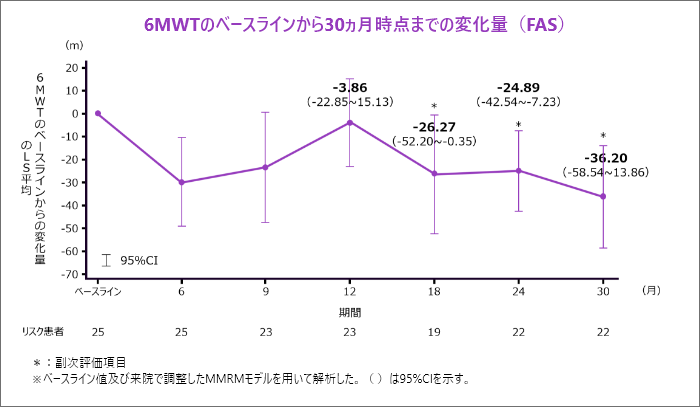
6MWTのベースラインから12、18、24及び30ヵ月時点までの変化量[主要評価項目、副次評価項目]
- 6MWTのベースラインから12ヵ月時点までの変化量の最⼩⼆乗(LS)平均は-3.86m(95%CI:-22.85~15.13)であり、95%CIの下限が-60mを上回っているため、Part Aでの成功基準を満たしました。[主要評価項目]
- 6MWTのベースラインから30ヵ月時点までの変化量のLS平均は-36.20mでした。[副次評価項目]
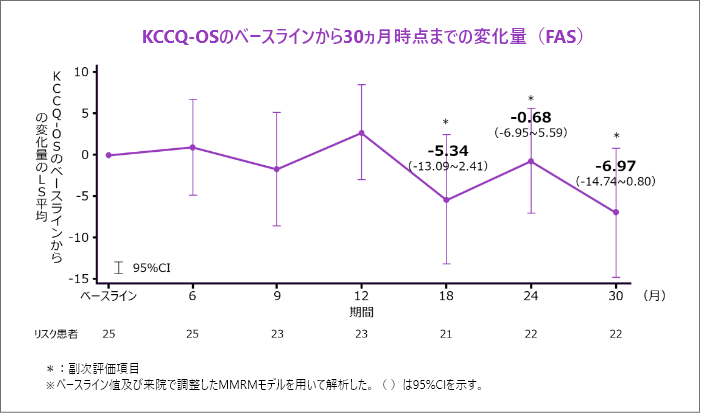
KCCQ-OSのベースラインから18、24 及び30ヵ月時点までの変化量[副次評価項目]
- KCCQ-OSのベースラインから30ヵ月時点までの変化量のLS平均は-6.97ポイントでした。
血清TTRレベルのベースラインから30ヵ月時点までの変化量[副次評価項目]
- 血清TTRレベルのベースラインからの変化量のLS平均は、14日時点で9.73mg/dL、30ヵ月時点で9.36mg/dLでした。

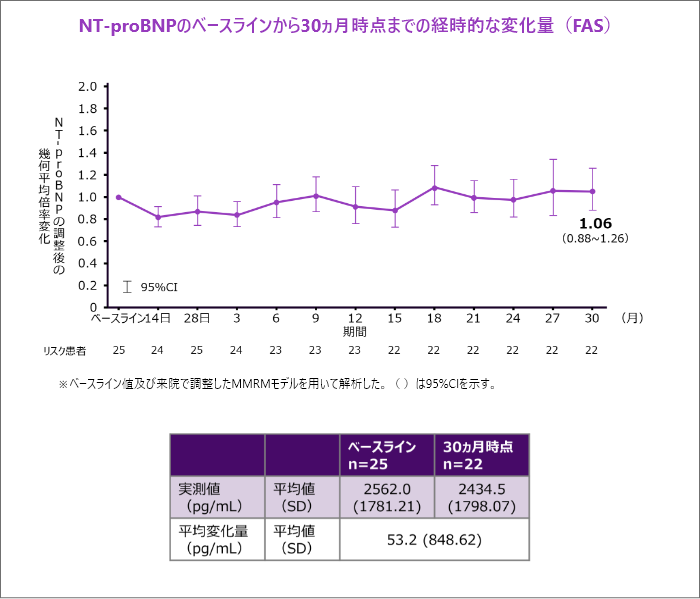
NT-proBNPのベースラインから30ヵ月時点までの変化量[探索的評価項目]
- NT-proBNPのベースラインから30ヵ月時点までの幾何平均倍率変化は1.06でした。なお、30ヵ月時点のベースラインからの平均変化量は53.2pg/mLでした。
3. 安全性
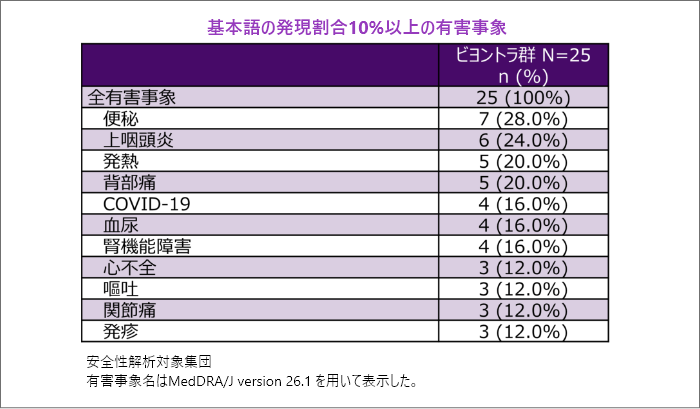
有害事象
- 主な有害事象(発現割合10%以上)は便秘、上咽頭炎、発熱、背部痛等でした。
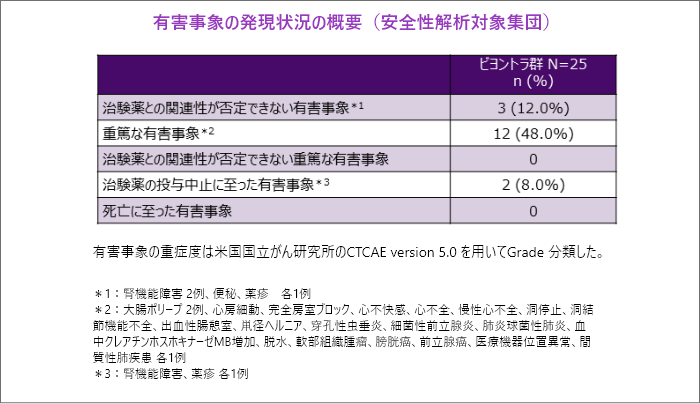
重篤な有害事象
- 重篤な有害事象は48%(25例中12例)に認められましたが、全例で治験薬との関連性が否定されました。治験薬の投与中止に至った有害事象は8%(25例中2例)に認められました。
- 本試験では死亡例は認められませんでした。
電子添文は、こちらよりご覧いただけます。







